Тирозинкиназа
Что такое тирозинкиназа?
Тирозинкиназа - это особая группа ферментов, которые функционально отнесены к протеинкиназам с биохимической точки зрения. Протеинкиназы обратимо переносят (возможность обратной реакции) фосфатные группы на группу ОН (гидроксильная группа) аминокислоты тирозин. Фосфатная группа переносится на гидроксильную группу тирозина другого белка.
Посредством этого описанного обратимого фосфорилирования тирозинкиназы могут решающим образом влиять на активность белков и, следовательно, играть важную роль в путях передачи сигналов. В частности, в терапевтических целях, например, в онкологии, функция тирозинкиназ используется в качестве мишени для лекарственных препаратов.

Задача и функция
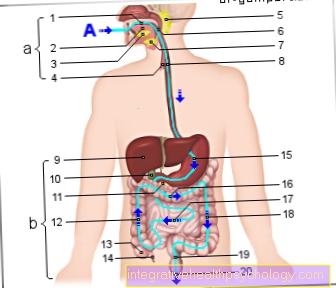
Тирозинкиназы необходимо сначала разделить на тирозинкиназы, связанные с мембраной, и тирозинкиназы, не связанные с мембраной, чтобы понять, как они функционируют.
Связанные с мембраной тирозинкиназы могут обладать собственной протеинкиназной активностью, причем функция киназы активируется как часть рецепторного комплекса на клеточной мембране.В противном случае мембраносвязанные тирозинкиназы могут быть функционально связаны с рецепторным комплексом, но не могут быть непосредственно в нем локализованы. Тирозинкиназа и рецептор создают связь, через которую определенный сигнал передается киназе через рецептор.
В случае тирозинкиназы, не связанной с мембраной, она находится либо в цитоплазме, либо в ядре клетки. Различные примеры тирозинкиназ могут быть названы в зависимости от структурного дизайна с ассоциированной функцией. Примерами мембраносвязанных тирозинкиназ являются рецептор инсулина, рецептор EGF, рецептор NGF или рецептор PDGF. Это показывает, что сигнальные каскады с помощью тирозинкиназ являются жизненно важными процессами в организме человека.
Высвобождение инсулина из поджелудочной железы во время еды регулируется через рецептор инсулина. Рецептор EGF имеет сайты специфического связывания для нескольких лигандов, среди которых следует упомянуть EGF или TNF-альфа. В качестве белкового лиганда EGF (эпидермальный фактор роста) играет выдающуюся роль фактора роста (пролиферации и дифференцировки клеток). TNF-альфа, с другой стороны, является одним из самых мощных воспалительных маркеров в организме человека и играет важную диагностическую роль в диагностике воспаления.
PDGF, в свою очередь, представляет собой фактор роста, выделяемый тромбоцитами (тромбоцитами), который вызывает закрытие ран и, согласно текущим исследованиям, также способствует развитию легочной гипертензии.
Примерами не связанных с мембраной тирозинкиназ являются киназы ABL1 и Janus.
В принципе, сигнальный каскад с определенной информацией всегда протекает таким же стереотипным образом в случае тирозинкиназы. Во-первых, подходящий лиганд должен связываться с рецептором, который обычно находится на поверхности клеток. Эта связь обычно устанавливается через конгруэнтную белковую структуру лиганда и рецептора (принцип «замок и ключ») или через связывание с определенными химическими группами рецептора (фосфатные, сульфатные группы и т. Д.). Связь изменяет структуру белка рецептора. В частности, в случае тирозинкиназ рецептор образует гомодимеры (две идентичные белковые субъединицы) или гетеродимеры (две разные белковые субъединицы). Эта так называемая димеризация может привести к активации тирозинкиназ, которые, как уже упоминалось выше, расположены непосредственно в рецепторе или на цитоплазматической стороне (направленной внутрь клетки) рецептора.
Активация связывает гидроксильные группы тирозиновых остатков рецептора с фосфатными группами (фосфорилирование). Это фосфорилирование создает сайты узнавания для локализованных внутри клетки белков, которые впоследствии могут с ними связываться. Они делают это через определенные последовательности (домены SH2). После связывания с фосфатными группами в ядре клетки запускаются сложные сигнальные каскады, которые, в свою очередь, приводят к фосфорилированию.
Следует отметить, что на активность белков можно влиять в обоих направлениях через фосфорилирование тирозинкиназами. С одной стороны, они могут быть активированы, но с другой стороны, они также могут быть отключены. Можно видеть, что дисбаланс активности тирозинкиназы может привести к чрезмерной стимуляции процессов, связанных с фактором роста, что в конечном итоге позволяет клеткам тела размножаться и дедифференцироваться (потеря клеточного генетического материала). Это классические процессы развития опухоли.
Дефектные механизмы регуляции тирозинкиназ также играют решающую роль в развитии сахарного диабета (рецептор инсулина), артериосклероза, легочной гипертензии, некоторых форм лейкемии (особенно ХМЛ) или немелкоклеточного рака легких (НМРЛ).
Узнайте все по теме здесь: Опухолевые заболевания.
Что такое рецептор тирозинкиназы?
Рецептор тирозинкиназы представляет собой рецептор на основе мембраны, то есть рецептор, закрепленный в клеточной мембране, структурно это рецептор с трансмембранным комплексом. Это означает, что рецептор проходит через всю клеточную мембрану, а также имеет внеклеточную и внутриклеточную стороны.
Специфический лиганд связывается с рецептором на внеклеточной стороне, с альфа-субъединицей, в то время как каталитический центр рецептора находится на внутриклеточной стороне, с бета-субъединицей. Каталитический центр представляет собой активную область фермента, где происходят определенные реакции.
Как уже упоминалось выше, структура рецептора обычно состоит из двух белковых субъединиц (димеров).
В случае рецептора инсулина, например, две альфа-субъединицы связывают инсулиновый лиганд. После связывания лиганда фосфатные группы (так называемое фосфорилирование) связываются со специфическими остатками тирозина (гидроксильными группами). Это генерировало активность тирозинкиназы рецептора. Далее дополнительные белки-субстраты (например, ферменты или цитокины) внутри клетки могут быть активированы или инактивированы посредством возобновленного фосфорилирования, тем самым влияя на пролиферацию и дифференцировку клеток.
Что такое ингибитор тирозинкиназы?
Так называемые ингибиторы тирозинкиназы (также: ингибиторы тирозинкиназы) являются относительно новыми препаратами, которые можно использовать для специфического лечения недостаточной активности тирозинкиназы. Они классифицируются как химиотерапевтические средства и появились в конце 1990-х - начале 2000-х годов. Их можно разделить на разные поколения и использовать при лечении злокачественных заболеваний.
Функционально определенные процессы можно предотвратить за счет несбалансированной активности тирозинкиназы. В принципе, здесь возможны четыре различных механизма действия. Помимо конкуренции с АТФ, также возможно связывание с фосфорилирующей единицей рецептора, с субстратом или аллостерически вне активного центра. Эффект ингибиторов тирозинкиназы запускается связыванием с рецептором EGF и последующим ингибированием ферментативной активности тирозинкиназ.
С точки зрения истории болезни открытие активного ингредиента иматиниба в качестве ингибитора тирозинкиназы достигло выдающейся позиции. Он используется специально при хроническом миелоидном лейкозе (ХМЛ), где он подавляет активность тирозинкиназы, патологически создаваемую слиянием хромосом (филадельфийская хромосома путем слияния хромосом 9 и 22).
В последние годы было разработано несколько других ингибиторов тирозинкиназы. Существующее в настоящее время 2-е поколение содержит около десяти ингибиторов тирозинкиназы.
Подробнее по теме здесь:
- Таргетная химиотерапия ингибиторами тирозинкиназы
- Хронический миелолейкоз.
По каким показаниям они используются?
Ингибиторы тирозинкиназы используются при различных злокачественных заболеваниях. Иматиниб используется, в частности, при хроническом миелоидном лейкозе. Другие возможные применения - это немелкоклеточный рак легких (НМРЛ), рак груди и рак толстой кишки.
Из-за очень избирательного механизма атаки ингибиторов тирозинкиназы они обычно лучше переносятся, чем обычные химиотерапевтические агенты. Тем не менее, здесь подробно следует ожидать и побочных эффектов.
Узнайте больше о: Рак легких.




.jpg)






.jpg)